எரிமக்கலன்களை, பின்வருமாறு வகைப்படுத்தலாம்.
(i) கார எரிமக்கலன் (Alkaline Fuel Cell)
(ii) உருகிய கார்பனேட் எரிமக்கலன் (Molten Carbonate Fuel Cell)
(iii) பாலிமர் மின்வேதிப் பொருள் எரிமக்கலன் (Polymer Electrolyte Fuel Cell)
(iv) நேரடியாக மெத்தனால் பயன்படுத்தும் எரிமக்கலன்
(Direct Methonal Fuel Cell)
(v) பாஸ்பாரிக் அமில எரிமக்கலன் (Phosphoric Fuel Cell)
(vi) திட நிலை ஆக்ஸைடு எரிமக்கலன் (Solid Oxide Fuel Cell)
என்று வகைப்படுத்தலாம்.
இவற்றில் பாலிமர் மின்வேதிப் பொருள் எரிமக்கலனை Polymer Membrane Fuel Cell அல்லது PEM Fule Cell என்றும், நேரடி மெத்தனால் எரிமக்கலனை DMFC (Direct Methanol Fuel Cell) என்றும் திட நிலை ஆக்ஸைடு எரிமக்கலனை SOFC என்றும் சுருக்கமாக சொல்வார்கள்.
முதலில் கார எரிமக்கலன் பற்றிய விவரங்களைப் பார்ப்போம். இதில் பொட்டாசியம் ஹைட்ராக்ஸைடு (KOH) என்ற பொருள் இருக்கும். இது காரத்தன்மை (Alkaline of Basic) வாய்ந்தது. இந்த எரிமக்கலனின் வடிவமைப்பு இங்கே கொடுக்கப்பட்டுள்ளது.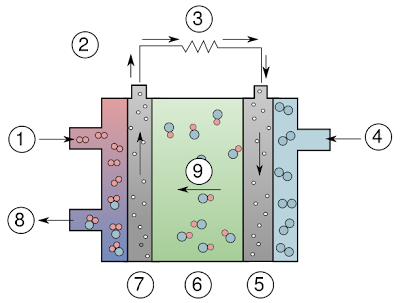 இந்தப் படம் விக்கியிலிருந்து எடுக்கப்பட்டு உள்ளது. இதில், (1) ஹைட்ரஜன் உள்ளே செல்லும் வழி. (2) மற்றும்(3)மின்சாரம் செல்லும் பாதை. (4) ஆக்சிஜன் செல்லும் வழி. (5). கேத்தோடு/Cathode எனப்படும் மின் தகடு. (6). KOH கரைசல் (7). ஆனோடு/Anode எனப்படும் மின் தகடு (8)வினை புரியாமல் மிச்சம் இருக்கும் ஹைட்ரஜனும், வினை முடிவில் வந்த தண்ணீரும் வெளியே செல்லும் வழி. (9). ஹைட்ராக்சில் அயனி (OH- )செல்லும் பாதை.
இந்தப் படம் விக்கியிலிருந்து எடுக்கப்பட்டு உள்ளது. இதில், (1) ஹைட்ரஜன் உள்ளே செல்லும் வழி. (2) மற்றும்(3)மின்சாரம் செல்லும் பாதை. (4) ஆக்சிஜன் செல்லும் வழி. (5). கேத்தோடு/Cathode எனப்படும் மின் தகடு. (6). KOH கரைசல் (7). ஆனோடு/Anode எனப்படும் மின் தகடு (8)வினை புரியாமல் மிச்சம் இருக்கும் ஹைட்ரஜனும், வினை முடிவில் வந்த தண்ணீரும் வெளியே செல்லும் வழி. (9). ஹைட்ராக்சில் அயனி (OH- )செல்லும் பாதை.
இதில் இருக்கும் மின் தகடுகள் துவாரங்கள் உள்ள கரியில் செய்யப்பட்டு இருக்கும். அதன் மேல் பிளாட்டினம் பூச்சு கொடுக்கப் பட்டு இருக்கும். (துவாரங்கள் உள்ள கரி = Porous Carbon. பிளாட்டினம் = தங்கத்தைவிட விலை உயர்ந்த தனிமம்).
ஹைட்ரஜன் வாயு (துவாரங்கள் அல்லது ஓட்டைகள் நிறைந்த) கரி மின் தகட்டின் வழியே செலுத்தப்படும். அது பொட்டாசியம் ஹைட்ராக்சைடை அடையும் இடத்தில் பிளாட்டினம் வினை ஊக்கியும் இருக்கும். அங்கு கீழ்க்கண்ட வினை நடைபெறும்.
H2 + 2 OH- = 2H2O + 2 e-
சாதாரணமாக, ஒரு ஹைட்ரஜன் மூலக்கூறு(H2) காரத்தில் இருக்கும் ஹைட்ராக்ஸைடு(OH-) அயனியுடன் நேரடியாக வினையில் அவ்வளவு சுலபமாக ஈடுபடாது. அந்த வினையை நடத்த பிளாட்டினம் வினையூக்கி தேவைப்படுகிறது. அது விலை அதிகம் என்பதால், பூச்சாக மட்டும் (coating only) உபயோகிக்கிறோம்.
இந்த வினையில் வரும் தண்ணீரானது, பொட்டாசியம் ஹைட்ராக்ஸைடை கரைக்கும். முதலில் பொட்டாசியம் ஹைட்ராக்ஸைடு 35 அல்லது 40 சதவிகிதம் இருக்கும். எரிமக்கலன் வேலை செய்யும் பொழுது தண்ணீரின் அளவு அதிகமாகலாம். ஆனால் நாம் உள்ளே அனுப்பும் எல்லா ஹைட்ரஜனும் வினை புரியாது. கொஞ்சம் திரும்பி வரும். அது கொஞ்சம் தண்ணீரையும் ஆவியாகக் கொண்டு வரும். (நம் வீட்டில் துணிமணிகளை சீக்கிரம் உலர வைக்க மின் விசிறியைப் பயன்படுத்துகிறோம் அல்லவா? அதைப் போல ஹைட்ரஜனை செலுத்தி தண்ணீரைச் சரியாக எடுக்கலாம்)
காரத்திலிருந்து சில ஹைட்ராக்ஸைடு அயனிகள்(OH-) வினை புரிந்து அவற்றின் அளவு குறையும். அதே சமயம், எரிமக்கலனின் மறுபக்கத்தில் ஆக்ஸிஜன் வாயு, OH- அயனிகளை உருவாக்கும்.
O2 + 2 H2O + 4 e- = 4 OH-
இதனால் மொத்தத்தில்
2 H2O + O2 = 2H2O
என்ற வினையே நடக்கிறது.
கார எரிமக்கலன்களில் ஒரு முக்கிய குறைபாடு உண்டு. பொதுவாக ஆக்ஸிஜன் வாயுவிற்குப் பதிலாக காற்று செலுத்தப்படும். காற்றில் பெரும்பங்கு ஹைட்ரஜன் வாயுவும், மீதி ஆக்ஸிஜனும் இருக்கும். சிறிய அளவில் கார்பன்-டை-ஆக்ஸைடு(CO2) இருக்கும். சில வாயுக்கள் இருக்கும். இதில் கார்பன்-டை-ஆக்ஸைடு வாயுவானது KOH உடன் வினைபுரிந்து அதை பொட்டாசியம் கார்பனேட்டு என்ற பொருளாக மாற்றி விடும்.
2KOH + CO2 = K2CO3 + H2O
அதனால் எரிமக்கலன் வேலை செய்யாது. (இது பெட்ரோலில் தண்ணீர் கலப்பது போல. வண்டி ஓடாது). எனவே உள்ளே செலுத்தப்படும் காற்றில் இருந்து CO2 வாயுவை முழுமையாக நீக்க வேண்டும். இதற்குத் தனியாகச் செலவாகும். அதனால் மொத்தத்தில் மின்சாரம் தயாரிக்கும் செலவு கொஞ்சம் அதிகமாகும்.
இங்கு வினைஊக்கியாக பிளாட்டினம் பயன்படும் என்பதனைக் கண்டோம். பிளாட்டினம் விலையுயர்ந்த பொருள். அதனால் பிளாட்டினம் வினையூக்கியைப் பயன்படுத்தினால் முதலீடு அதிகம் தேவைப்படும்(High Initial Investment Cost). அதற்குப் பதிலாக தற்போது விலை குறைந்த (அதே சமயம் நன்றாக வேலை செய்யக்கூடிய) வினையூக்கிகள் பயன்படுத்தப்படுகின்றன.
நிக்கல்(Nickel-Ni) என்ற உலோகத்தின் துகள்களை எடுத்து அதிக வெப்ப நிலையிலும் அழுத்தத்திலும் வைத்தால் தகடு போன்ற அமைப்பை உருவாக்கலாம். அது அதிக அளவு துளை / ஓட்டைகளையும் பரப்பளவையும் கொண்டிருக்கும்.(Porous and High Surface Area) இது பிளாட்டினத்திற்குப் பதிலாக வினையூக்கியாகப் பயன்படும். அப்போலோ வகை விண்கலங்களில் இதுவே எரிமக்கலனில் உபயோகப்பட்டது.
ரானே உலோகம்(Raney Metal) என்ற வகைப்பொருளும் வினையூக்கியாகப் பயன்படும். ரானே உலோகம் என்றால் என்ன.? நிக்கல் அல்லது வெள்ளி போன்ற நமக்குத் தேவையான உலோகத்தைச் சிறிய துகள்களாக்கிக் கொள்ள வேண்டும்.
அதன் பிறகு அலுமினியத் துகள்களை இந்த உலோகத் துகள்களுடன் கலக்க வேண்டும். இக்கலவையை வெப்பத்திற்கும், அழுத்தத்திற்கும் உட்படுத்தினால் (High Temperature and Pressure) அது தகடுபோல் ஆகிவிடும். இதிலிருந்து அலுமினியத்தை நீக்கிவிட்டால், நமக்குத் தேவையான (நிக்கல் அல்லது வெள்ளி) உலோகம் அதிகப் பரப்பளவு மற்றும் துளைகளுடன் (High Surfree area and Pocosity) இருக்கும். அவ்வாறு அலுமினியத்தை நீக்க, இந்த (வெள்ளி, அலுமினியம் அல்லது நிக்கல்+அலுமினியம்) தகட்டை அடர்ந்த காரத்தில்(Concentrated Alkali) வைக்கலாம்.
அப்போது அலுமினியம் காரத்தில் கரைந்துவிடும். மிச்சம் இருக்கும் உலோகம்(நிக்கல் அல்லது வெள்ளி) ரானே நிக்கல் என்று அழைக்கப்படும். குறிப்பு : இம்முறையைக் கண்டுபிடித்தவர் அமெரிக்காவை சேர்ந்த முர்ரே ரானே(Murray Raney) என்பவர். அதனால் இவ்வகையில் தயாரிக்கப்பட்ட உலோகம் ரானே உலகம் எனப்படும்.
இதைத் தவிர கரி(கார்பன்=Carbon) மற்றும் டெஃப்ளான்(Teflon) என்ற பொருளுடன் நிக்கலைச் சேர்த்து ஒரு வகை மின் தகடும் தயாரிக்கப்பட்டு உபயோகத்தில் உள்ளது. ஆனால் அதில் பல குறைபாடுகள் இருப்பதால் அதிக அளவில் பயன்படுவதில்லை.
உருகிய கார்பனேட்டு எரிமக் கலன் பற்றி அடுத்த பதிவில் பார்க்கலாம்.
http://fuelcellintamil.blogspot.com/2008/02/types-of-fuel-cells.html
